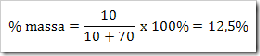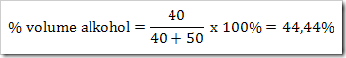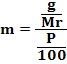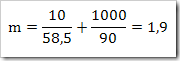Reaksi Redoks
1. Metode bilangan oksidasi, yang digunakan untuk reaksi yang berlangsung tanpa atau dalam air, dan memiliki persamaan reaksi lengkap (bukan ionik).
2. Metode setengah reaksi (metode ion elektron), yang digunakan untuk reaksi yang berlangsung dalam air dan memiliki persamaan ionik.
Meyetarakan persamaan Reaksi Redoks
1. Metode bilangan oksidasi
Prinsip dasar metode ini adalah jumlah kenaikan bilangan oksidasi dari reduktor (zat yang teroksidasi) sama dengan jumlah penurunan bilangan reduksi dari oksidator (zat yang tereduksi). Untuk menyetarakan persamaan redoks dengan metode ini, harus ditempuh langkah-langkah sebagai berikut:
1. Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
2. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
3. Tentukan jumlah berkurang dan bertambahnya bilangan oksidasi.
4. Setarakan jumlah perubahan jumlah bertambah dan berkurangnya bilangan oksidasi tersebut dengan memberi koefisien yang sesuai.
5. Setarakan unsur-unsur yang lainnya dalam urutan kation, anion, hidrogen, dan terakhir oksigen (KAHO).
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode bilangan oksidasi:
MnO(s) + PbO2 (s) + HNO3 (aq)→ HMnO4(aq) + Pb(NO3)2 (aq)+ H2O(l)
Jawab:
Langkah 1, tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
+2 -2 +4 -2 +1 +5 -2 +1 +7 -2 +2 +5 -2 +1 -2
MnO(s) + PbO2 (s) + HNO3 (aq)→ HMnO4(aq) + Pb(NO3)2 (aq)+ H2O(l)
oksidasi
reduksi
Langkah 2, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
Terdapat 1 atom Mn di ruas kanan dan kiri, sehingga tidak perlu disetarakan
Terdapat 1 atom Pb di ruas kanan dan kiri, sehingga tidak perlu disetarakan
Langkah 3, tentukan jumlah berkurang dan bertambahnya bilangan oksidasi.
Oksidasi: +2 +7
MnO → HMnO4
jumlah kenaikan b.o = (jumlah atom Mn) x (kenaikan b.o per atom Mn)
= (1) x (5) = 5
Reduksi: +4 +2
PbO2 → Pb(NO3)2
Jumlah penurunan b.o = (jumlah atom Pb) x (penurunan b.o per atom Pb)
= (1) x (2) = 2
Langkah 4, setarakan jumlah perubahan jumlah bertambah dan berkurangnya bilangan oksidasi tersebut dengan memberi koefisien yang sesuai.
Untuk menyamakan perubahan bilangan oksidasi, maka dilakukan perkalian silang berikut:
Oksidasi: MnO → HMnO4 (x 2) diperoleh 2MnO → 2HMnO4
Reduksi: PbO2 → Pb(NO3)2 (x 5) 5PbO2 → 5Pb(NO3)2
Persamaan reaksi menjadi:
2MnO + 5PbO2 + HNO3→ 2HMnO4 + 5Pb(NO3)2 + H2O
Langkah 5, setarakan unsur-unsur yang lainnya dalam urutan kation, anion, hidrogen, dan terakhir oksigen (KAHO).
Kation, tidak ada
Anion NO3-, jumlah anion NO3- di ruas kiri = 1 dan di ruas kanan = 10. jadi setarakan NO3- dengan mengubah koefisien HNO3 ruas kiri dari 1 menjadi 10.
2MnO + 5PbO2 + 10HNO3→ 2HMnO4 + 5Pb(NO3)2 + H2O
Hidrogen. Jumlah atom hidrogen di ruas kiri 10 dan di ruas kanan 4. jadi, setarakan H dengan mengubah H2O di ruas kanan dari 4 menjadi 10.
2MnO + 5PbO2 + 10HNO3→ 2HMnO4 + 5Pb(NO3)2 + 4H2O
Oksigen. Jumlah atom oksigen di ruas kanan = 42 dan di ruas kiri =42. jadi sudah setara.
Jadi, persamaan yang diperoleh adalah
2MnO + 5PbO2 + 10HNO3→ 2HMnO4 + 5Pb(NO3)2 + 4H2O
2. Metode setengah reaksi atau metode ion elektron
Prinsip dasar metode setengah reaksi adalah pemisahan reaksi oksidasi dan reaksi reduksi dalam reaksi redoks. Masing-masing reaksi tersebut dinamakan setengah reaksi oksidasi dan setengah reaksi reduksi. Kedua reaksi ini kemudian disetarakan secara terpisah, sebelum digabungkan kembali untuk memperoleh persamaan reaksi redoks yang sudah setara secara keseluruhan.
Ada beberapa hal yang perlu diperhatikan pada metode ini, yaitu:
Persamaan reaksi redoks merupakan penjumlahan dua setengah reaksi.
Jumlah elektron yang dilepaskan pada oksidasi sama dengan jumlah elektron yang ditangkap pada reduksi.
Suasana berlangsungnya reaksi.
Metode setengah reaksi digunakan untuk reaksi redoks yang memiliki persamaan reaksi ionik dimana serah terima elektron digambarkan dengan jelas. Pembahasan metode ini, dibagi menjadi dua kondisi, yaitu untuk suasana asam dan suasana basa atau netral.
a. Reaksi redoks untuk larutan asam
Penyetaraan reaksi redoks untuk kondisi asam dilakukan dengan penambahan ion H+. Untuk menyetarakan persamaan redoks pada suasana asam, harus ditempuh langkah-langkah sebagai berikut:
1. Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
2. Tulislah kerangka setengah reaksi reduksi dan oksidasinya.
3. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
4. Setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
5. Setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
6. Setarakan muatan dengan menambahakan elektron (e-) ke ruas yang meuatannya lebih positif
7. Samakan jumlah elektron pada reaksi reduksi dan oksidasi
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode setengah reaksi:
Cu(s) + NO3-(aq) + H+(aq) → Cu2+(aq) + NO2 (g) + H2O (l)
Jawab:
Langkah 1, tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
0 +5 -2 +1 +2 +4 -2 +1 -2
Cu(s) + NO3-(aq) + H+(aq) → Cu2+(aq) + NO2 (g) + H2O (l)
oksidasi
reduksi
Langkah 2, tulislah kerangka setengah reaksi reduksi dan oksidasinya.
Reduksi: NO3- → NO2
Oksidasi: Cu → Cu2+
Langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
Karena jumlah atom N dan Cu sudah setara, tidak ada yang perlu dilakukan
Reduksi: NO3- → NO2
Oksidasi: Cu → Cu2+
Langkah 4, setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
Reduksi: NO3- → NO2 + H2O
Oksidasi: Cu → Cu2+
Langkah 5, setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
Reduksi: 2H+ + NO3- → NO2 +H2O
Oksidasi: Cu → Cu2+
Langkah 6, setarakan muatan dengan menambahkan elektron (e-) ke ruas yang muatannya lebih positif.
• Pada reaksi reduksi, muatan ruas kiri = 1 x (muatan NO3-) = 1x (3-) =3-
Muatan ruas kanan = 2 x (muatan H+) = 2 x (1+) = 2+
Jadi, muatan ruas kiri (3-) dan ruas kanan (2+) dapat disetarakan dengan penambahan 1 e- di ruas kanan.
• Pada reaksi oksidasi, muatan ruas kiri = 0
Muatan ruas kanan = (muatan Cu2+) = 2-
Jadi, muatan ruas kiri (0) dan ruas kanan (2-) dapat disetarakan dengan penambahan 2 e- di ruas kiri.
Reduksi: H2O + NO3- → NO2 +2H+ + e-
Oksidasi: 2e- + Cu → Cu2+
Langkah 7, Samakan jumlah elektron pada reaksi reduksi dan oksidasi dengan perkalian silang atau jika jumlah elektron pada reaksi reduksi dan oksidasi adalah kelipatan, maka gunakan faktor terkecil. Lalu, jumlahkan kedua setengah reaksi tersebut.
Reduksi: H2O + NO3- → NO2 +2H+ + e- (x2) 2H2O + 2NO3- → 2NO2 + 4H+ +2e-
Oksidasi: 2e- + Cu → Cu2+ (x1) 2e- + Cu → Cu2+ + Redoks: 2H2O + 2NO3- + Cu → 2NO2 + 4H+ + Cu2+
Jadi, persamaan yang diperoleh adalah
2H2O + 2NO3- + Cu → 2NO2 + 4H+ + Cu2+
b. Reaksi redoks untuk larutan basa atau netral
Penyetaraan reaksi redok untuk larutan basa atau meta sama dengan larutan asam. Langkah 1-7 untuk larutan asam masih berlaku. Kita hanya perlu menambahkan langkah ke 8 dan 9,yaitu penambahan OH- dan perolehan total reaksi redoks. Untuk menyetarakan persamaan redoks pada suasanabasa, harus ditempuh langkah-langkah sebagai berikut:
1. Tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
2. Tulislah kerangka setengah reaksi reduksi dan oksidasinya.
3. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
4. Setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
5. Setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
6. Setarakan muatan dengan menambahakan elektron (e-) ke ruas yang meuatannya lebih positif
7. Samakan jumlah elektron pada reaksi reduksi dan oksidasi
8. Menambahkan OH- di ruas kiri dan kanan. Jumlah OH- harus sama dengan jumlah H+ yang ada. OH- dan H+ membentuk H2O.
9. Periksa apakah ada spesi yang sama di ruas kiri dan kanan. Jika ada,kurangi jumlah spesi yang lebih besar dengan yang lebih kecil.
Untuk lebih jelasnya, perhatikanlah contoh berikut:
Setarakan reaksi berikut dengan metode setengah reaksi:
Au (s) + CN-(aq) +O2(g)→ Au(CN)4- (aq) +OH- (aq)
Jawab:
Langkah 1, tulislah bilangan oksidasi setiap unsur untuk mengetahui unsur mana yang mengalami perubahan bilangan oksidasi.
0 +4-3 0 +2 +4-3 -2 +1
Au (s) + CN- (aq) +O2(g)→ Au(CN)4- (aq) + OH- (aq)
reduksi
oksidasi
Langkah 2, tulislah kerangka setengah reaksi reduksi dan oksidasinya.
Reduksi: Au → Au2+
Oksidasi: O2→ OH-
Langkah 3, setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi antara ruas kiri dengan ruas kanan dengan menambah koefisien yang tepat.
Reduksi: Au → Au2+
Oksidasi: O2→ OH- (tidak ada)
Langkah 4, setarakan oksigen (O) dengan menambahkan H2O ke ruas yang kekurangan O
Reduksi: Au → Au2+
Oksidasi: O2→ OH- + H2O
Langkah 5, setarakan hidrogen (H) dengan menambahkan H+ ke ruas yang kekurangan atom H
Reduksi: Au → Au2+
Oksidasi: 3H++O2→ OH- + H2O
Langkah 6, setarakan muatan dengan menambahkan elektron (e-) ke ruas yang muatannya lebih positif.
• Pada reaksi reduksi, muatan ruas kiri = 0
Muatan ruas kanan = 1 x (muatan Au2+) =1 x (2+) = 2+
Jadi, muatan ruas kiri (0) dan ruas kanan (2+) dapat disetarakan dengan penambahan 2 e- di ruas kanan.
• Pada reaksi oksidasi, muatan ruas kiri = 3 x (muatan H+) =3 x (1+) = 3+
Muatan ruas kanan = 1x (muatan OH-) = 1x (1-) = 1-
Jadi, muatan ruas kiri (3+) dan ruas kanan (1-) dapat disetarakan dengan penambahan 4 e- di ruas kiri.
Reduksi: Au → Au2+ + 2e-
Oksidasi: 4e- +3H++O2→ OH- + H2O
Langkah 7, Samakan jumlah elektron pada reaksi reduksi dan oksidasi dengan perkalian silang atau jika jumlah elektron pada reaksi reduksi dan oksidasi adalah kelipatan, maka gunakan faktor terkecil. Lalu, jumlahkan kedua setengah reaksi tersebut.
Reduksi: Au → Au2+ + 2e- (x2) 2Au → 2Au2+ + 4e-
Oksidasi: 4e- + 3H+ +O2→ OH- + H2O (x1) 4e- + 3H+ +O2→ OH- + H2O +
Reaksi redoks:2Au +3H+ +O2→ 2Au2+ +OH-+H2O
Langkah 8, Menambahkan OH- di ruas kiri dan kanan. Jumlah OH- harus sama dengan jumlah H+ yang ada. OH- dan H+ membentuk H2O.
Reaksi redoks: 3OH- + 2Au + 3H+ + O2→ 2Au2+ + OH-+ H2O + 3OH-
Reaksi redoks: 3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH-
Langkah 9, Periksa apakah ada spesi yang sama di ruas kiri dan kanan. Jika ada,kurangi jumlah spesi yang lebih besar dengan yang lebih kecil.
Reaksi redoks: 3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH- (tidak ada)
Jadi, persamaan yang diperoleh adalah
3H2O + 2Au + O2→ 2Au2+ + H2O + 4OH-